Пищевая сода, или, как её называют иначе, столовая, питьевая, чайная, знакома, пожалуй, всем: её используют для придания тесту пышности и рыхлости, для очищения посуды и кафеля, для уничтожения вредителей в саду и огороде, для устранения огрубевшей кожи со стоп и отбеливания зубов – перечислять можно долго, однако при всём этом мало кто задумывается о химических свойствах порошка или о том, какая формула у соды. И совершенно зря, поскольку знание природы вещества и сведений относительно его физических и химических качеств зачастую позволяет расширить кругозор относительно возможностей и сфер его использования.
К тому же, далеко не всем известно, что сода имеет несколько разновидностей, которые отличаются друг от друга не только по своим характеристикам, но и по степени безопасности для здоровья человека. Вот как раз об этом мы и поговорим.
Определение и формула соды
В понятие «сода» химики включают все натриевые соли угольной кислоты, и таковых, в зависимости от химического соединения, всего 3.
- Пищевая (чайная, питьевая, столовая) – наиболее распространённый вариант, с химической точки зрения именуемый как бикарбонат натрия, гидрокарбонат натрия, натрий двууглекислый или пищевая добавка Е500. Вещество представляет собой мелкокристаллический порошок, который характеризуется белым цветом, слабовыраженным запахом и наличием солёно-горького вкуса. В науке пищевая сода обозначается записью NaHCO₃
- Кальцинированная сода (техническая, стиральная) – вещество, получившее своё второе название по причине его использования в качестве средства для стирки белья и одежды. Карбонат натрия (так именуют его химики) внешне очень подобен пищевой соде, однако путать два этих вещества не стоит: кальцинированная сода является щёлочью сильного действия, которая при неправильном и неосторожном обращении может вызывать раздражения и ожоги слизистых и кожных покровов. Химическая формула карбоната натрия выглядит следующим образом: Na₂СО₃
- Каустическая сода (каустик) – известна как едкая щёлочь, едкий натр, имеет и другое название – гидрокссид натрия. Вещество обладает сильно выраженными щелочными характеристиками, имеет вид твёрдых гранул белого цвета, у которых отсутствует какой-либо запах. Несмотря на то, что едкий натр зарекомендовал себя как эффективное чистящее средство, использовать его следует осторожно: высокая концентрация гидроксида натрия разъедает соединения органического происхождения и вызывает ожоги кожи. В области химии каустическая сода обозначается формулой NaOH
Таким образом, принципиальная разница между тремя названными разновидностями заключается в степени щелочной реакции, которую они способны создавать, и, соответственно, в сферах деятельности человека, где они могут использоваться.
Характеристики аптечной соды
Как используется неядовитое для человека и полезное во многих отношениях вещество — гидрокарбонат натрия? Применение основано на физических и химических свойствах питьевой соды. Важнейшие направления — бытовое потребление, пищевая промышленность, здравоохранение, народная медицина, получение напитков.
Среди основных свойств бикарбоната натрия — нейтрализация повышенной кислотности желудочного сока, кратковременное устранение болевого синдрома при гиперацидности желудочного сока, язвенной болезни желудка и 12-перстной кишки. Антисептическое действие раствора питьевой соды применяется при лечении боли в горле, кашля, интоксикации, морской болезни. Промывают им полости рта и носа, слизистые оболочки глаз.
Широко используются разные лекарственные формы бикарбоната натрия, например порошки, которые растворяют и применяют для инфузий. Назначают растворы для приема пациентами внутрь, промывают ожоги кислотами. Для изготовления таблеток и ректальных суппозиториев также используется гидрокарбонат натрия. Инструкция к препаратам содержит подробное описание фармакологического действия, показаний. Список противопоказаний очень короткий — индивидуальная непереносимость вещества.
- фармацевтика и медицина;
- химическая отрасль;
- легкая промышленность;
- пищевая промышленность.
Рассмотрим более подробно каждое из направлений.
- При лечении простудных заболеваний пищевая сода избавляет от кашля, так как способствует разжижению и выведению мокроты из легких и бронхов. Также с ней можно делать ингаляции при ОРВИ.
- Как бактерицидное и противовоспалительное средство также используется сода пищевая. Формула ее отражает наличие катионов водорода Н , которые и обеспечивают данный эффект.
- Для лечения сердечно-сосудистых заболеваний (аритмии и гипертонии) применяется слабый раствор в воде двууглекислого натрия.
- При диареях и рвоте использование соды совместно с солью позволяет восполнить водный запас организма и восстановить необходимый баланс.
- Вещество способно уничтожать грибковые заболевания, поэтому его применяют для устранения грибка стопы, делают спринцевание раствором при молочнице, промывают глаза при воспалениях коньюнктивы.
- Благодаря отбеливающим свойствам соду используют для чистки зубов.
- Слабый раствор позволяет избавиться от зуда при кожных высыпаниях (или укусах насекомых).
- Лечение ожогов начальной степени.
- Освобождение организма от солей тяжелых металлов.
- Происходит снятие стресса и усталости, а также избавление от лишнего веса при использовании теплой ванны с NaHCO3 и эфирными маслами.
О пользе и вреде пищевой соды при использовании в медицинских целях, в том числе в косметологии, можно сказать много. Главное правило применения данного средства, как и любого другого лекарства, – не пренебрегать рекомендациями по дозировке. Неправильное использование может нанести вред здоровью.
- При длительном использовании раствора внутрь возникает эффект кислотного рикошета. Это процесс, при котором выделяется избыточное количество углекислого газа в организме, приводящее к усилению уровня кислотности и повышенному газоотведению, вздутию живота.
- Долгий контакт с порошком способен вызывать раздражения и высыпания на коже.
- Попадание сухой порошковой соды в глаза, нос или на другие слизистые оболочки организма вызывает химические ожоги.
- При использовании порошка для отбеливания зубов истончается и ухудшается зубная эмаль.
- Частое употребление NaHCO3 внутрь способно вызвать чувство непроходящей тошноты.
Поэтому очевидно, что не только положительную роль для человека играет сода пищевая. Польза и вред, лечение – это неоднозначные аспекты. Прежде чем повсеместно использовать гидрокарбонат натрия для избавления от разных недугов, следует проконсультироваться с врачом. Если же применяется сода в быту (чистка поверхностей, отбеливание тканей и так далее), то не стоит пренебрегать самыми простыми средствами защиты для бесконтактного использования вещества.
Пищевая сода
Пожалуй, в каждом доме есть картонная коробочка, дизайн которой не меняется вот уже много лет. В ней содержится белый мелкокристаллический порошок, практически не обладающий запахом, но отличающийся немного горьковатым вкусом, – речь идёт о пищевой соде, которая используется людьми в различных целях и становится настоящим помощником по удалению загрязнений, уничтожению вредителей, лечению различных заболеваний.
Первая сода, полученная искусственным путём, появилась лишь в XVIII веке, благодаря опытам французского учёного Анри Дюамеля де Монсо, который с этой целью использовал метод кристаллизации. Промышленным способом содовый порошок стали производить сначала в России: этому послужило открытие химика Э. Лаксмана, выяснившего, что при спекании древесного угля и смеси сульфата натрия можно получить натрий двууглекислый. Однако широкого распространения данная методика всё же не получила, и со временем, начиная с 1791 года, содовый порошок стали производить посредством сплавления древесного угля, смеси сульфата натрия и мела. Такая технология была открыта французским учёным Н. Лебманом. С 1838-1840-х г был предложен аммиачный метод, который отличался не только экономичностью, но и возможностью получать соду более высокого качества. С тех пор и до настоящего времени натрий двууглекислый получают именно этим способом.
Гидрокарбонат натрия характеризуется рядом определённых химических свойств: при нагревании до 60 С он начинает плавится, в результате чего распадается на карбонат натрия, углекислый газ и воду. Именно таким образом из натрия двууглекислого получают другую разновидность – кальцинированную соду. Вещество не растворяется в ацетоне и спирте, однако довольно хорошо растворяется в тёплой или горячей воде. При взаимодействии с ней образуется раствор, обладающий слабощелочной средой, в связи с чем соду, которая по своей сути является натриевой солью угольной кислоты, нередко называют щёлочью. рН воды, в которой растворяется бикарбонат натрия, равен 8-9, что и указывает на не агрессивность получаемого содержимого. Нередко такое вещество используют в качестве лечебного средства, при помощи которого понижают повышенную кислотность и борются с изжогой, грибковыми заболеваниями, неприятным запахом изо рта.
Химическая реакция также происходит в результате соединения натрия двууглекислого с кислотами и, в частности, с уксусом. При взаимодействии этих двух компонентов пищевая сода начинает выделять углекислый газ и воду, вследствие чего можно наблюдать специфическое «шипение». Именно такую реакцию мы получаем на кухне при замешивании теста: высвобождение углекислого газа в результате взаимодействия натрия двууглекислого и уксуса способствует «росту» пирога и приданию ему рыхлости и воздушности.
Интересное видео: Химическая реакция уксуса с содой красиво
Однако применяется содовый порошок не только в сфере кулинарии: зачастую он «спасает» тогда, когда под рукой не оказывается чистящих средств, но есть загрязнения, которые нужно срочно устранить. При помощи соды можно избавиться от многих пятен на поверхности стола или холодильника, вымыть посуду и кафель. За счёт безопасности для здоровья, пищевую соду можно применять в качестве очищающего средства для мытья именно детской посуды, ведь ни одна промышленная жидкость не может похвастаться таким важным критерием. Называть качества гидрокарбоната натрия, которые могут быть полезными для человека, можно довольно долго, но об этом мы поговорим несколько позже.
Реакции
Многие свойства пищевой соды возможны благодаря некоторым химическим реакциям соды с водой, кислотами, в частности, с уксусом и высокой температурой.
Реакции с водой
Разведенная в воде сода превращается в слабый щелочной раствор. «Слабый» означает, что реакция щелочи не агрессивная, следовательно, может применяться внутрь человека. Это отличает ее от кальцинированной соды, чей раствор слишком агрессивен для слизистых оболочек организма.
Водородный показатель pH содового раствора (сода, растворенная в воде) составляет 8,1 – 9,0. Это физическое подтверждение того, что сода, растворяясь в воде, становится щелочью.
Реакции с кислотами
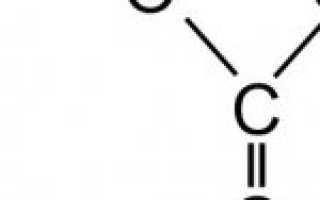
Щелочь всегда вступает в реакцию с кислотой. Каждая хозяйка, что пробовала самостоятельно стряпать выпечку, сталкивалась с этой реакцией, когда «гасила» соду уксусом. Пищевая сода, реагируя на уксусную кислоту, выделяет углекислый газ и воду.
Рисунок 2 – Химическая реакция пищевой соды и уксусной кислоты.
«Шипение» соды химически выглядит следующим образом (рисунок 2):
- сначала образуется соль натрия и угольная кислота,
- затем сразу же угольная кислота расщепляется на воду и углекислый газ.
Зачем в тесто добавляют гашеную соду? Затем, что химическая реакция пищевой соды и уксусной кислоты высвобождает углекислый газ, он-то и «поднимает» тесто, делая его мягким и воздушным.
Реакция на высокие температуры
Если подвергнуть гидрокарбонат натрия температурному воздействию (от 60 до 200 градусов), то она станет карбонатом натрия (кальцинированной содой), высвободит воду и углекислый газ (рисунок 3).
Рисунок 3 – Химическая реакция пищевой соды на высокую температуру.
Кальцинированная, или бельевая, техническая сода
Ещё одна разновидность соды – карбонат натрия, или кристаллическая, бельевая, стиральная сода. Своё второе название она получила в соответствии с той сферой, в которой применяется: вещество отлично устраняет различные загрязнения, в виду чего его иногда используют вместо стирального порошка.
Формула кальцинированной соды выражается записью Na2CO3. Вещество выпускают в двух формах: в виде крупных кристаллов (тип А) и в виде порошка (тип В). В зависимости от критерия принадлежности к одной из марок, карбонат натрия применяется в различных областях.
Кальцинированная сода характеризуется белым цветом и отсутствием запаха, она хорошо растворяется в воде и довольно легко впитывает запахи и влагу, превращаясь при этом в твёрдое вещество. Карбонат натрия является сильной щёлочью (рН 11), поэтому обращаться с ним нужно крайне осторожно.
В промышленности кальцинированную соду получают несколькими методами:
- из нефелинового сырья;
- из соды, добываемой в природе;
- аммиачно-хлоридным способом;
- посредством карбонизации каустической соды.
Интересное видео: Технологии производства соды
Естественным путём соду добывают из золы морских водорослей, некоторых озёр, а также в подземных солях в виде минералов термонатрита, натрона, трона, нахколита. Странами, богатыми данным веществом, являются США, Россия, Канада, Мексика, ЮАР, Кения. Из пластиковых металлов соду получают посредством прокаливания, а из озёр – при помощи кристаллизации.
Самый распространённый метод получения соды – аммиачно-хлоридный. Данная технология изготовления позволяет производить вещество высокого качества, но при минимуме затрат. В условиях низких температур раствор хлористого натрия подвергается насыщению двуокисью углеводорода и аммиаком. Вследствие этого процесса выпадает осадок натрия двууглекислого, который проходит фильтрацию и дальнейшее кальцинирование. Именно так и получается кальцинированная сода.
Что это такое?
Кристаллическая сода представляет собой кристалл непрозрачного белого цвета, который добывают из отложений минералов и содовых озер. Согласно государственному стандарту различают соду марки А и В, соответственно гранулированную и порошкообразную. Кристаллы вещества относятся к 3 –му классу опасности в связи с активными химическими связями. Однако, не считаются пожаро- и взрывоопасными. Сода способна быстро впитывать влагу (повышенная гигроскопичность), при соединении с водой приобретает агрессивные свойства. Поэтому в условиях высокой влажности с ней надо работать очень внимательно. На открытом воздухе она при поглощении влаги и углекислоты образует кислую соль. Поэтому ее надо хранить в помещении с контролем влажности. Термин «сода» произошел от растения с аналогичным названием Soda, ее добывали из его золы. Кристаллической или кальцинированной она называется из-за способа получения: кристаллогидрат нужно нагреть для образования соды. Природным источником также считаются морские водоросли и минералы: термонатрит, натрон, нахколит.
Отличия от пищевой соды
Кристаллическая сода отличается от остальных видов другим составом, показателем водорода. Ее нельзя принимать во внутрь, она может вызывать аллергические реакции, дерматиты. Общими признаками являются противомикробные свойства.
Способы ее получения
Кристаллическую соду получают от природного сырья, аммиачным способом, из нефелина, путем карбонизации гидроксида натрия. Широко известные из них:
- Получение из природного сырья стало возможным благодаря открытиям залежей вещества в Соединенных Штатах. Метод заключается в переработке щелока и рапы, причем выделяют не только углекислый натрий, но и другие компоненты.
- Способ Леблана заключается в сплавке смеси угля натрия сульфата при высоких температурах в специальных вращающихся печах. Происходит образование сырой соды, которая постепенно выщелачивается в результате реакции с водой.
Каустическая сода
Наиболее сильной щёлочью из всех разновидностей соды выступает едкий натр, или, иначе говоря, каустик, каустическая сода. В области химии данное вещество носит название гидроксид натрия и имеет формулу NaOH. При высоких концентрациях каустическая сода способна разъедать соединения органического происхождения, вызывать ожоги и сильные раздражения, она обладает и рядом других опасных свойств, в связи с чем её транспортируют исключительно в водонепроницаемых мешках.
Внешне гидроксид натрия представляет собой твёрдое вещество белого цвета, у которого отсутствует какой-либо запах. Каустик прекрасно растворяется в спиртовых растворах и воде, но не взаимодействует с эфирами и ацетоном. Кроме того, едкий натр вступает в реакцию с оловом, цинком, свинцом, алюминием, а с аммиаком – воспламеняется. Каустическая сода не горит, однако кипит и плавится при температуре, составляющей не менее 390 С. Вещество обладает способностью к нейтрализации загрязнений и жиров, в связи с чем оправдано его применение в качестве очищающего средства.
В промышленности гидроксид натрия производят, начиная с середины XVIII века. Вплоть до ХХ столетия при изготовлении едкого натра применялась аммиачная и известковая технология получения. Впоследствии был открыт электрохимический метод, который является приоритетным до сегодняшнего дня. Ведущие позиции по производству каустической соды сейчас занимают такие страны, как США, Китай, а также многие европейские государства.
Способы получения
В современном мире имеется несколько методов синтеза кальцинированной соды. Самым экологичным из них является разработка минералов, в составе которых она содержится: натрон, трона, нахколит, термонатрит. Значимые месторождения этих веществ находятся в Соединенных Штатах Америки, Мексике, Канаде, африканских странах.
Первый промышленный способ получения углекислого натрия был запатентован французом Николя Лебланом. Он заключался в совместном плавлении сульфата натрия, карбоната кальция (мела) с древесным углем. В этой реакции образуются сульфид кальция, карбонат натрия. После завершения реакции полученный состав заливают водой, в котором сульфид кальция выпадает в осадок, а сода растворяется. Последующее выпаривание воды позволяет получить ее кристаллическую форму. На основании этого метода был построен завод, который производил около 100 килограммов кальцинированной соды в день.
Второй способ был предложен в Англии Хеммингом и Гаррисоном. Он заключается в пропускании через очищенную воду аммиака и углекислого газа с образованием гидрокарбоната аммония. К полученному веществу добавляли поваренную соль, что позволяло в реакции замещения получить гидрокарбонат натрия (пищевую соду), который с помощью нагревания превращался в карбонат натрия, воду и углекислый газ. Этот метод отличался некоторой сложностью и через некоторое время практически перестал использоваться.
Сода является химически активной, но очень полезной и применяется повсеместно
Третий способ, который используется в современной промышленности и в наше время, был предложен и запатентован бельгийским химиком Сольве. Он немного отличается от метода англичан и заключается в пропускании аммиака, а затем углекислого газа через раствор хлорида натрия. В результате гидрокарбонат натрия при холодной температуре выпадает в осадок. Затем он подвергается фильтрованию и кальцинации при температуре 140−160 градусов. Плюсами этого способа является небольшая затрата энергии, достаточная экономичность и использование распространенных в природе веществ, таких как поваренная соль, мел или известняк, аммиак.
Существуют также другие методы получения кальцинированной соды, например, из содопоташных растворов, при переработке нефелинового сырья и в процессе электролиза воды и диоксида углерода с гидроксидом натрия. Эти способы имеют гораздо меньшее распространение из-за своей сложности или необходимости использования не слишком распространенных компонентов.
Небольшое количество карбоната натрия можно получить в домашних условиях. Для этого в нагретый раствор пищевой соды добавляют порошок извести или мела. После фильтрования получится раствор кальцинированной соды, который можно использовать для бытовых нужд.
Общие химические свойства соды
Все три разновидности соды относятся к классу натриевых солей угольной кислоты. Они обладают щелочными характеристиками при взаимодействии с водой, но уровень рН при этом отличается, в связи с чем только пищевая сода может применяться в домашней кулинарии и народной медицине, поскольку именно гидрокарбонат натрия имеет самый низкий водородный показатель. За счёт того, что любой вид соды можно по праву назвать щёлочью, использовать каждое из веществ допускается с целью устранения жира и загрязнений: гидрокарбонат натрия, а также кристаллическая и каустическая сода прекрасно справляются с данной задачей.
Сходство химических свойств заключается не только в принадлежности к солям, имеющим щелочные качества, но и в способности достаточно хорошо растворяться в воде. Кроме того, и пищевая, и кальцинированная сода не взаимодействуют со спиртовыми растворами, то есть не могут растворяться в них, чем одновременно отличаются от едкого натра.
От степени агрессивности веществ зависит место их применения: если гидрокарбонат натрия активно используется в быту, кулинарии и при лечении различных заболеваний, то сфера, в которой просто необходимо участие карбоната и гидроксида натрия, – это промышленность.
Контактировать с кальцинированной содой и особенно каустиком следует очень осторожно: оба вещества, за счёт высокого уровня рН, являются сильными раздражителями, которые могут спровоцировать ожоги слизистой и кожных покровов и даже вызвать интоксикацию организма.
Области применения
Трудно найти область, где столовая сода не используется:
1) Химическое производство. Гидрокарбонат натрия лежит в основе производства бытовой химии (порошки, чистящие и моющие средства), красителей, органики, составляющих порошка огнетушителя. Известно, что обычную пищевую соду домохозяйки используют как самостоятельное чистящее средство.
2) Легкая промышленность. Сода используется при пропитывании кожи, резины для подошв дубильными веществами. Производство текстиля также не обходится без бикарбоната натрия.
3) Кулинария. Еще не нашли замену соде при создании всевозможных кондитерских изделий и выпечки. Шипучие напитки, типа колы и различных лимонадов, в основе своей имеют реакцию соды и кислоты.
Известная всем столовая сода имеет код пищевой добавки – Е500.
4) Косметология. Во многих масках и очистительных средствах в качестве главного ингредиента входит гидрокарбонат натрия, способный вывести шлаки и лишнюю жидкость, отбелить зубы и лицо, снять покраснение и зуд, убрать неприятный запах.
Читайте подробнее: Маски с содой для лица.
5) Медицина. Почти во всех рецептах лекарственных препаратов традиционной и народной медицины присутствует бикарбонат натрия. Он способен выводить из организма различные токсины, включая тяжелые металлы.
Известно, что сода спасает от изжоги, но и в основе всех брендовых лекарственных препаратов (Гастал, Гевискон и прочие) лежит способность солей натрия нейтрализовать высокую кислотность (щелочное свойство пищевой соды).
Антисептические свойства пищевой соды незаменимы в борьбе с вирусами, бактериями и грибками.
Народная медицина считает соду просто лекарственной панацеей: сода лечит головную и зубную боль; способна понизить температуру; нейтрализовать ожоги кислотой кожи и слизистых оболочек; и даже вылечить рак.
Применение
Самым распространённым вариантом в домашнем обиходе является гидрокарбонат натрия. Чаще всего его используют в кондитерском деле, поскольку при взаимодействии пищевой соды и уксуса происходит выделение углекислого газа, придающего выпечке пышную и рыхлую структуру. К слову сказать, именно натрий двууглекислый выступает основным компонентом привычного всем разрыхлителя, который в кулинарии зачастую применяется вместо самой пищевой соды. Однако только этим важность компонента на кухне не ограничивается. Некоторые хозяйки идут на уловку и добавляют данное вещество в омлет, за счёт чего он получается не только вкусным, но и воздушным. Другие применяют содовый порошок для размягчения слишком жёсткого мяса или ускорения процесса приготовления гороха, фасоли. При помощи пищевой соды допускается промывание фруктов и овощей: это позволяет уничтожить нитраты, а заодно – продлить срок их хранения. Если добавить небольшое количество соды в кастрюлю, можно предотвратить прилипание круп к её дну или свёртывание молока в процессе его кипячения.
Видео — 20 НЕОБЫЧНЫХ ПРИМЕНЕНИЙ СОДЫ | ЛАЙФХАКИ С СОДОЙ
Ещё одно, несомненно, важное достоинство гидрокарбоната натрия – наличие у данного вещества целого спектра лечебных свойств: противогрибкового, антисептического, антибактериального, дезинфицирующего, смягчающего. Чаще всего пищевую соду используют для нейтрализации повышенной кислотности в организме и последующего восстановления водного баланса.
Натрий двууглекислый становится настоящим помощником при:
- боли в горле во время простудных заболеваний;
- изжоге;
- ожогах, раздражениях, вызванных укусами насекомых;
- молочнице, грибковых поражениях стоп;
- отбеливании зубной эмали;
- инфекционных заболеваниях полости рта;
- интоксикации, в том числе и алкогольной;
- обезвоживании организма;
- остеохондрозе, болях в суставах, подагре;
- аритмии и повышенном АД;
- морской болезни;
- фурункулах, натоптышах, мозолях;
- гипергидрозе;
- похудении;
- онкологических заболеваниях (согласно одной из теорий).
В быту актуальным становится абсолютно любой вид соды, однако контактировать с карбонатом или гидроксидом натрия следует очень осторожно, в связи с чем перед началом работы рекомендуется надевать резиновые перчатки. Средства достаточно эффективно справляются с различными загрязнениями, однако для удаления давнишних пятен рекомендуется использовать кальцинированную соду, которая также подойдёт для освежения деталей стиральной машины и уничтожения с них накипи.
При помощи пищевой соды можно до блеска вычистить раковину, столешницу, сантехнику, ковры, посуду, при этом необходимо помнить, что изделия из алюминия отмывать с применением даже неагрессивного гидрокарбоната натрия нельзя, так как они покрыты специальной оксидной плёнкой, предохраняющей металл от окисления и проникновения в пищу вредных компонентов. Однако пищевая сода станет находкой для очищения других деликатных поверхностей: линолеума, мрамора, кафеля. Её использование актуально в том случае, если нужно избавиться от неприятного запаха, например, в холодильнике. А вот для отбеливания белья и устранения пятен с одежды чаще всего применяют кальцинированную соду, поскольку именно карбонат натрия с подобной задачей справляется гораздо лучше.
В промышленности широкой популярностью пользуется каустическая сода. Она принимает участие в следующих отраслях:
- целлюлозно-бумажная: производство искусственных волокон, картона и бумаги;
- строительство: укрепление фундаментов, изготовление газобетона;
- текстиль: отбеливание тканей и регенерация резины;
- химическая промышленность: очищение нефтепродуктов, производство масляной продукции;
- военная отрасль: применение в противогазе с целью устранения углекислого газа из воздуха, нейтрализация опасных газов.
Также каустическая сода используется практически на каждом предприятии, поскольку выполняет роль средства, очищающего промышленное оборудование и инвентарь от жира и загрязнений. Вместе с тем, едкий натр нередко выступает компонентом, входящим в состав стиральных порошков, мыла, косметической продукции.
Медицинское применение аптечной соды
Вещество NaHCO3 считается питьевой содой не потому, что употребляется внутрь для утоления жажды. Хотя с помощью этого вещества можно приготовить шипучий напиток. Раствор этого гидрокарбоната принимают внутрь при повышенной кислотности желудочного сока. При этом происходит нейтрализация избытка протонов Н , которые раздражают стенки желудка, вызывают боль и жжение.
Аптечной содой называется натрия гидрокарбонат повышенной очистки. Он проходит более тщательную очистку от примесей, в результате которой остается более 99% чистого вещества. Используется как в официальной медицине, так и в лечении народными методами.
Медицинская сода выпускается в нескольких формах:
- Порошок для приготовления растворов, используемых в инфузионной терапии. Выпускается в пакетах по 50 гр. каждый.
- Готовый 4% раствор для инфузионной терапии. Выпускается в контейнерах объемом 2 мл., 5 мл., 100 мл., 250 мл. Также выпускается в бутылках объемом 100 мл., 200 мл., и 400 мл.
- Порошки для изготовления растворов, служащих для местного применения (для промывания кожи, слизистых, верхних дыхательных путей и т.д.) или перорального приема. Выпускаются в бумажных пакетах по 10 гр., 25 гр., и 50 гр.
- Таблетки с дозировкой 0,3 и 0,5 гр.
- Свечи для ректального введения. Выпускаются с дозировкой 0,3 гр., 0,5 гр. и 0,7 гр. Свечи продаются по 10 суппозиториев в одной упаковке.
Также стоит вспомнить о препарате «Флит фосфо-сода«, который действует как слабительное.
В фармацевтике формула аптечного содового порошка выглядит так: основное вещество NaHCO3, содержание которого не ниже 99,3%. Дополнительные компоненты: Na2CO3 с содержанием не превышающим 0,3% и другие примеси, количество которых не превышает одну сотую часть от основного объема.
При одновременном использовании медицинской соды и тетрациклиновых антибиотиков эффективность последних снижается, поэтому врачи не рекомендуют одновременное проведение содовой терапии и прием антибиотиков тетрациклинового ряда.
Количество каждого вещества тщательно проверяется и контролируется на производственном этапе, готовый препарат проходит контрольную проверку перед выпуском.
Срок хранения препарата составляет 2 года, хранить необходимо при температуре 15—30 °C в тёмном месте.
Основное отличие между пищевой и аптечной содой кроется в составе вещества. Медицинский содовый порошок изготавливается в строго соответствии со всеми фармакологическими требованиями и содержит в составе 99,3% натрия двууглекислого, 0,5% углекислого натрия и минимальное количество сульфатов и хлоридов.
Аптечная сода нашла применение в лечении широкого спектра заболеваний:
- Различные виды ацидоза, в том числе — послеоперационный ацидоз или ацидоз, вызванный диабетической комой.
- Избыточная кислотность, язва желудка и двенадцатиперстной кишки.
- Воспалительные процессы, возникающие в полости рта (стоматиты, гингивиты и т.д.) и верхних дыхательных путях. Также используется в качестве средства, разжижающего густой секрет в бронхах.
- Воспалительные заболевания глаз.
Также используется для:
- Снятия дискомфорта при воспалительных процессах в мочевыводящих путях. В этом случае назначается при отсутствии осложнений.
- Разрыхления ушной серы.
- Облегчения симптомов воздушной и морской болезни.
Капельницы используются строго под наблюдением врача, который контролирует уровень pH крови. Вливание проводится либо с чистым раствором, либо в сочетании с 5% раствором глюкозы, готовящимся в пропорции 1:1. Взрослым введение раствора осуществляется внутривенно при помощи капельницы либо ректально, детям — только внутривенно. Суточная доза инфузии у взрослых не должна превышать 200 мл.
Таблетки из соды рекомендуются при появлении воспалительных процессов в бронхах, сопровождающихся затрудненным отхождением мокроты. Для приема внутрь при изжоге рекомендуется использовать содовые таблетки только в крайнем случае и после обязательной консультации с врачом — в чистом виде сода оказывает сильное раздражающее действие на желудок, что приводит к повышению выработки соляной кислоты.
Лечебный раствор широко применяется для ингаляций, обработки кожи в случае попадания кислот, полосканий при лечении воспалений в полости рта и глотки, промываний. Для полосканий применяется раствор 0,5-2%, который готовится из порошка. Для обработки кожных покровов — 2% содовый раствор.
Техника безопасности
Гидрокарбонат натрия при взаимодействии с водой в небольших концентрациях является нетоксичным для здоровья человека веществом. Однако это совершенно не говорит о том, что содовый порошок безопасен. По степени пожаро — и взрывоопасности он относится к 3-му классу. Отдельно следует рассматривать ограничения присутствия натрия двууглекислого в воздухе: 5 мг на куб.метр. Хранить вещество необходимо в недоступном для детей и животных месте.
Работая с карбонатом натрия, в целях предотвращения ожогов кожных покровов, необходимо надевать резиновые перчатки, что же касается каустической соды, то для контактирования с ней одних перчаток, как правило, недостаточно: кроме них, применяется маска, халат, а также специальные очки.
Соду можно по праву назвать универсальным средством, которое имеет довольно широкую популярность, за счёт своего применения в различных сферах деятельности. Однако одновременно с этим не стоит умалять её способность оказывать негативное воздействие на организм человека, в связи с чем рекомендуется помнить о мерах предосторожности, а также чётко соблюдать правильные пропорции при выполнении лечебных и бытовых растворов.
Советы доктора И.П. Неумывакина об использовании пищевой соды
Известный всему миру профессор, доктор медицинских наук, И.П. Неумывакин более 40 лет посвящал свои научные работы изучению влияния пищевой соды на оздоровление организма. По его мнению, главная причина возникновения болезней – это нарушение кислотно-щелочного баланса. А, как известно, сода способствует его восстановлению.
Профессор разработал специальную схему, по которой следует пить содовый раствор, как для лечения, так и для профилактики различных заболеваний. Попадая в кровь, сода разжижает ее и обновляет структуру, тем самым способствует снижению:
- солевых отложений,
- холестериновых бляшек,
- песка в почках.
И.П. Неумывакин советует не только принимать внутрь содовый раствор, но и полоскать им рот, принимать с ним ванны и делать очищающие маски для лица.
Книги и видеоролики с доктором пользуются огромной популярностью. Беседа «Сода и вода» с И.П. Неумывакиным о здоровье и очищении организма с помощью соды набрала более 1,5 миллиона просмотров:
Краткие сведения об истории открытия и использовании соды
Первые сведения о бикарбонате натрия появились еще в древней цивилизации Египта. Именно в тех краях были распространены несколько озер, содержащих природные источники соды. При пересыхании эти озера отдавали соду в виде белого порошка, а люди ее собирали. Использовалась она египтянами в качестве одного из компонентов при изготовлении средств мумификации. Формула пищевой соды тогда еще известна не была.
Конкретно как химическое соединение вещество было изучено много позже, примерно в XVIII веке. Именно тогда ученых заинтересовал этот порошок, образованный естественным природным путем. Тщательный анализ состава позволил определить качественный и количественный компонент соединения. Так появилась современная формула пищевой соды.
Большой вклад в развитие представлений о веществе и проявляемых им свойствах был внесен итальянским врачом Туллио Симончини. Ему принадлежат эксперименты, по результатам которых сода — возможный вариант лечения раковых опухолей. Однако на сегодняшний день точных данных, это подтверждающих, нет.
Сода пищевая: формула и использование в химической промышленности
Основная область, в которой применяется натрий двууглекислый, — это бытовая химия. Сода может выступать в роли мягкого абразивного средства для чистки поверхностей и их обезжиривания. Также она применяется как сырье при производстве красителей, пенопластов и фтористых соединений. Кроме того, на основе NaHCO3 изготавливают средства пожаротушения.
Нельзя представить, как бы развивалась без гидрокарбоната натрия бытовая химия. Пищевая сода — важный и нужный компонент для многих химических синтезов.
Пищевая сода: свойства и лечение. Вред и противопоказания к применению
На самом деле применение соды достаточно широко в самых различных отраслях промышленности и быта, в чем мы уже могли убедиться ранее. Ее необычные целебные, антибактериальные, отбеливающие, успокаивающие и заживляющие свойства используются при лечении разных недугов. Однако, как и у любого другого лекарства, у соды также есть и противоположная сторона. Она может вредной и очень опасной для здоровья. Ее показания к применению очевидны, но не менее важны и противопоказания, которые мы рассмотрим подробнее.
Применение в промышленности
Использование кальцинированной соды происходит на производстве большого количества продукции. В стекольной промышленности это вещество в зависимости от марки и сорта в больших количествах требуется для изготовления хрусталя, медицинских и оптических стеклянных изделий, строительных стеклоблоков. В металлургии оно нужно для получения чугуна, свинца, вольфрама, хрома. Химическая промышленность применяет карбонат натрия в изготовлении красок, пенопласта, средств бытовой химии, для пожаротушения. Производство текстиля использует соду для создания хлопчатобумажных тканей и шелка. Кроме того, данное вещество необходимо для производства резины, обработки кожи и изготовления кожзаменителей, мыловарения.
Такое широкое применение кальцинированной соды происходит благодаря ее дешевизне и доступности. Она может быть использована как составляющее вещество для химических реакций, а также в качестве катализатора процессов.
Эмпирическая формула
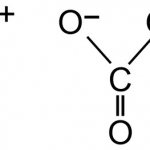
Формула пищевой соды — NaHCO3. То есть по своей природе данное вещество — это соль угольной кислоты, относящаяся к разряду кислых. Так как соединение образовано сильной щелочью и слабой кислотой, то при гидролизе (в водном растворе) будет щелочная реакция среды. Раствор в воде пищевой соды имеет рН 8,1. Кислая соль образуется легко при взаимодействии гидроксида натрия и угольной кислоты, процесс выражается следующим уравнением реакции:
NaOH + H2CO3 = NaHCO3 + H2O
Эмпирическая формула пищевой соды показывает количественный и качественный состав соединения, на основе которого можно сделать вывод о пространственном строении молекулы: положительно заряженный катион Na+ во внешней сфере и отрицательно заряженный гидрокарбонат-ион НСО3 — во внутренней.
Атом углерода координирует вокруг себя три атома кислорода, с одним из которых образует двойную связь. Также один из атомов кислорода соединяется с катионом водорода, образуя гидроксогруппу. Третий атом кислорода в виде иона ассоциируется возле катиона натрия. Таким образом, компенсируются валентности каждого элемента, входящего в состав данного соединения.